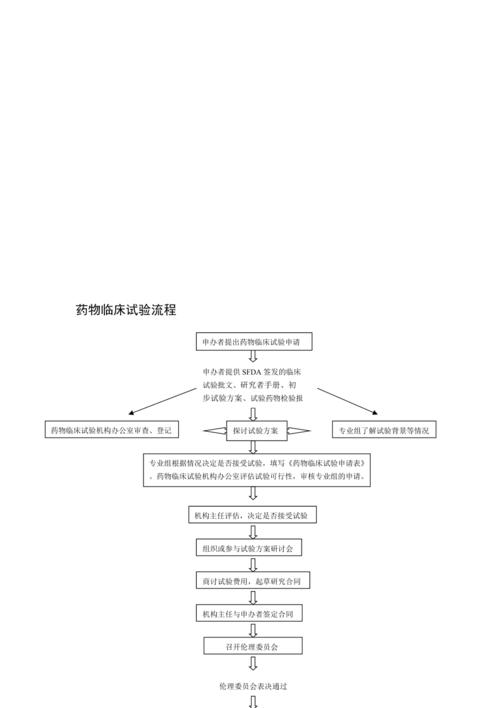
今天给各位分享临床试验的知识,其中也会对临床试验流程进行解释,如果能碰巧解决你现在面临的问题,别忘了关注本站,现在开始吧!
本文目录一览:
- 1、临床试验主要分几期?
- 2、临床试验的基本原则
- 3、临床试验的介绍
临床试验主要分几期?
1、临床试验主要分4期 Ⅰ期临床试验 包括初步的临床药理学、人体安全性评价试验及药代动力学试验
2、药品的临床试验为分4期。其中3期的临床试验要在药品正式上市之前完成。而4期临床试验,是在上市之后再进行的。临床试验主要用于研究药品的药效与风险,为上市审评时提供可靠的数据支撑。
3、临床试验分为I、II、III、IV期。I期临床试验:初步的临床药理学及人体安全性评价试验。观察人体对于新药的耐受程度和药代动力学,为制定给药方案提供依据。II期临床试验:治疗作用初步评价阶段。
4、临床试验分为Ⅰ、Ⅱ、Ⅲ、Ⅳ期。新药在批准上市前,申请新药注册应当完成Ⅰ、Ⅱ、Ⅲ期临床试验。
5、药物临床试验一般分为I、II、III、IV期临床试验。I期临床试验:初步的临床药理学及人体安全性评价试验。观察人体对于新药的耐受程度和新药在人体内的药代动力学过程,为制定给药方案提供依据。
6、药物临床试验是一般可以分为I、II、III、IV期临床试验以及药物生物等效性试验以及人体生物利用度的。那么它们分期试验目的是什么呢临床试验?跟着小编一起来看看吧。
临床试验的基本原则
1、临床试验临床试验的基本原则包括以下几个方面临床试验:伦理原则、科学原则、法律原则和监管原则。
2、临床试验的三项原则是随机、对照、盲法。临床试验简介:按照国家食品药品监督管理局颁布的《药物临床试验质量管理规范》中临床试验的定义。
3、由于药物临床试验的方法、手段、目的的特殊性临床试验,它必须遵循伦理道德原则、科学性原则、GCP与现行法律法规三项基本原则。而且药物临床试验必须有充分的科学依据。
4、随机化原则 随机化是临床科研的重要方法和基本原则之一在科研设计中临床试验,随机化方法包括两种形式。
5、简言之临床试验,需要遵循的原则应该是科学和伦理。具体实施中可以概括为3方面基本原则:1。
6、临床医学科学研究设计的基本原则包括重复原则、对照原则、随机原则。
临床试验的介绍
1、通过第一期实验耐受性试验:初步了解试验药物对人体的安全性情况,观察人体对试验药物的耐受及不良反应。还有药代动力学试验:了解人体对试验药物的处置,即对试验药物的吸收、分布、代谢、消除等情况。
2、临床试验分为I、II、III、IV期。I期临床试验:初步的临床药理学及人体安全性评价试验。观察人体对于新药的耐受程度和药代动力学,为制定给药方案提供依据。II期临床试验:治疗作用初步评价阶段。
3、药物的临床试验是一项非常严谨的工作。在任何国家或地区开展药物临床试验,都必须获得伦理委员会和药物监管部门的批准。伦理委员会是一个独立的审查机构或委员会。
关于临床试验和临床试验流程的介绍到此就结束了,不知道你从中找到你需要的信息了吗 ?如果你还想了解更多这方面的信息,记得收藏关注本站。